Los errores genéticos introducidos artificialmente que pueden cambiar a la especie humana
Zaria Gorvett - BBC Future | Lunes 03 mayo, 2021

He Jiankui parecía nervioso.
El investigador chino de la Universidad de Ciencia y Tecnología del Sur, en Shenzhen, había estado trabajando en un proyecto ultrasecreto durante los últimos dos años, y estaba a punto de subir al podio en la Cumbre Internacional sobre Edición del Genoma Humano para anunciar los resultados.
La audiencia miraba ansiosamente. La gente empezó a filmar en sus teléfonos. El biólogo había creado los primeros bebés genéticamente modificados en la historia de la humanidad.
Después de 3.700 millones de años de evolución continua y sin perturbaciones por selección natural, una forma de vida había tomado su biología innata en sus propias manos.
El resultado fueron niñas gemelas que nacieron con copias alteradas de un gen conocido como CCR5, que, el científico esperaba, las hiciera inmunes al VIH.
Pero las cosas no eran lo que parecían.
"Me convenció durante los primeros cinco o seis minutos, parecía muy sincero", dice Hank Greely, profesor de derecho en la Universidad de Stanford y experto en ética médica, quien vio la conferencia en vivo a través de internet en noviembre de 2018.
"Y luego, a medida que avanzaba, comencé a sospechar más y más".
Una invención genética
En los años posteriores, quedó claro que el proyecto de He no era tan inocente como parecía.
Había violado leyes, falsificado documentos, engañado a los padres de los bebés sobre los riesgos y no realizó las pruebas de seguridad adecuadas.
Todo esto dejó a muchos expertos horrorizados -fue descrito como "monstruoso" y "amateur"- y el investigador ahora está en prisión.

Sin embargo, lo más grave de todo fueron los errores que cometió.
Resulta que las bebés involucradas, Lulu y Nana, no han sido dotadas con genes cuidadosamente editados después de todo. No solo no son necesariamente inmunes al VIH, sino que se les ha dotado accidentalmente de versiones de CCR5 que están totalmente inventadas.
Es probable que no existan en ningún otro genoma humano del planeta. Y, sin embargo, tales cambios son heredables: podrían transmitirse a sus hijos, a los hijos de sus hijos, etc.
En experimentos con animales genéticamente modificados, se ha visto que este campo está plagado de errores y malentendidos.
Desde conejos alterados para ser más delgados que inexplicablemente terminaron con lenguas mucho más largas, hasta ganado modificado para carecer de cuernos que fue dotado de ADN bacteriano (incluidos algunos genes que confieren resistencia a los antibióticos).
Un 16%
Recientemente, investigadores del Instituto Francis Crick de Londres comprobaron que editar la genética de embriones humanos puede tener consecuencias no deseadas.
Al analizar los datos de experimentos anteriores, encontraron que aproximadamente el 16% tenía mutaciones accidentales que no se habrían detectado mediante pruebas estándar.
¿Por qué estos errores son tan comunes? ¿Se pueden remediar? Y ¿cómo podrían afectar a las generaciones futuras?
Esto puede parecer un problema para el futuro. Después de todo, el trabajo de He ha sido ampliamente condenado y los bebés de diseño son ilegales en muchos países, al menos por ahora.
Durante años, Lulu, Nana y un misterioso tercer bebé, cuya existencia solo se confirmó durante el juicio del científico, fueron las únicas personas editadas genéticamente en el planeta.
Pero esto podría estar a punto de cambiar, gracias a la edición de "células somáticas".
¿Qué es?
Se trata de una nueva técnica que se está desarrollando para tratar una variedad de enfermedades devastadoras, desde oscuros trastornos metabólicos hasta la principal causa de ceguera infantil.
Se considera que la tecnología representa un gran avance en el manejo de algunos de los trastornos hereditarios más difíciles de tratar, así como de enfermedades comunes como el cáncer.
Funciona así: en lugar de alterar el genoma de una persona mientras es un óvulo fertilizado o un embrión temprano, este método altera células ordinarias, como las de órganos específicos, como por ejemplo, el ojo.
Esto significa que los cambios no deberían ser heredados por la próxima generación. Pero, como ocurre con todas las ediciones de genes, no es tan simple.
"Digamos que estamos inyectando un editor de genoma en el cerebro para apuntar a las neuronas en el hipocampo", dice Krishanu Saha, un bioingeniero de la Universidad de Wisconsin-Madison que actualmente forma parte de un consorcio que investiga la seguridad de esta técnica.
"¿Cómo nos aseguramos de que esos editores del genoma no viajen a los órganos reproductivos y terminen alterando un espermatozoide o un óvulo?".
Por el momento, aún no se sabe qué tan probable es esto, pero Saha explica que es algo que están estudiando con detenimiento, especialmente porque parece que el tratamiento estará mucho más disponible durante la próxima década.
El año pasado se inyectó por primera vez un editor de genes en humanos, como parte de un ensayo clínico histórico.
Si las células reproductivas terminaran siendo alteradas, "ciertamente, tendríamos individuos que tienen nuevas variantes genéticas que podrían ser potencialmente muy problemáticas".
Un experimento fallido
Pero primero, volvamos a las bebés chinas editadas genéticamente, para una clase magistral sobre lo que puede salir mal cuando la técnica se maneja sin la debida precaución.
El objetivo de He era darles a las niñas una versión del gen CCR5 que está naturalmente presente en alrededor del 1% de los europeos del norte.
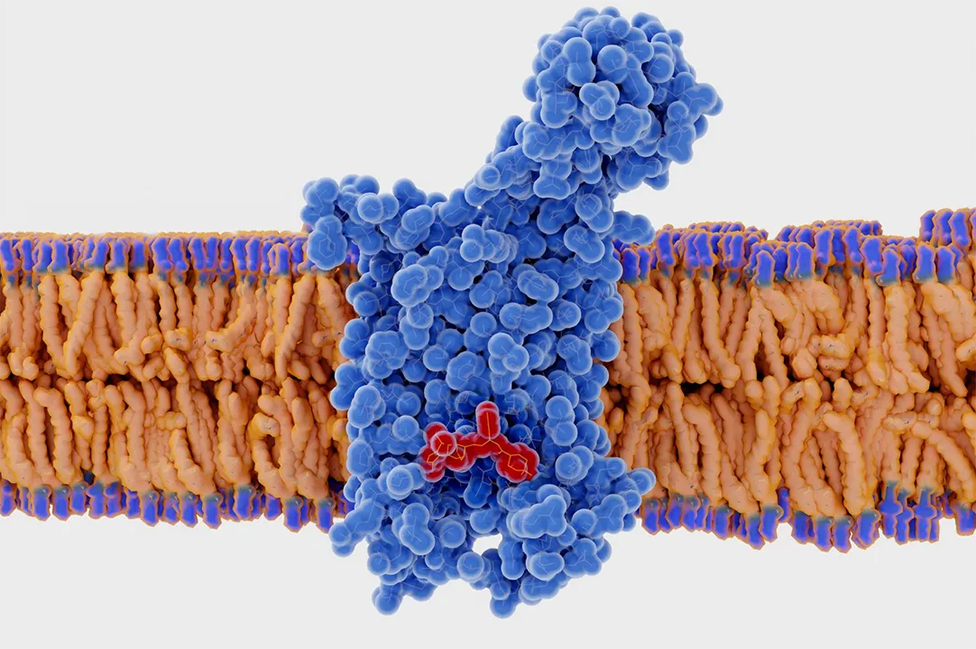
Cuando las personas con este gen están expuestas al VIH, el virus no puede ingresar al sistema y, en consecuencia, son inmunes.
Este era el objetivo, pero no funcionó como el científico esperaba. En cambio, tanto Lulu como Nana portan genes CCR5 nuevos, que son completamente diferentes del gen normal.
Nana porta dos genes alterados, mientras que Lulu tiene uno alterado y uno normal.
"Nunca antes habíamos visto estas proteínas CCR5 y no conocemos su función en el contexto de un ser humano", dice Saha. "Básicamente estamos haciendo ese experimento ahora".
Hoy la mayor parte de la edición de genes utiliza "Crispr", una especie de tijeras genéticas desarrolladas en 2012 por las científicas ganadoras del premio Nobel Emmanuelle Charpentier y Jennifer A Doudna.
- Cómo CRISPR, las "tijeras genéticas" que prometen revolucionar la medicina, fueron halladas por pura casualidad
- Las serias advertencias de unos científicos sobre los peligros de la técnica que revolucionó la genética
La tecnología se basa en el sistema inmunológico de muchas bacterias. Cuando se encuentran con una amenaza viral potencial, copian y pegan parte del ADN del virus en su propio genoma, luego lo usan para desarrollar un par de tijeras que pueden identificar esa secuencia exacta. Si alguna vez lo vuelven a encontrar, simplemente lo recortan y lo desactivan.
Este es más o menos el mismo proceso para editar células humanas: los científicos usan una secuencia guía para mostrar al sistema Crispr dónde unir y cortar, lo que les permite apuntar a ciertos genes con precisión y cortar segmentos no deseados.
El propio sistema de reparación de la célula repara la ruptura, dejando un genoma perfectamente alterado. Sin embargo, esto no siempre va según lo planeado.

Cambios no deseados
En el caso de las bebés chinas, el alteró una secuencia que resultó ser similar a la que se suponía que estaba cortando.
Es un problema común: un estudio reciente descubrió que la edición causaba cambios no deseados más de la mitad de las veces.
Si bien se cree que los dos genes CCR5 de Nana podrían protegerla del VIH, uno de los dos genes de Lulu mantuvo su versión natural, lo que significa que podría ser susceptible al virus.
El experimento no solo terminó inventando nuevas mutaciones, sino que no alteró todas las células.
Este efecto "mosaico" surge del hecho de que es más fácil editar embriones que alterar un óvulo recién fertilizado, que consta de una sola célula.
Pero al editar un embrión, no todo se ve necesariamente afectado de manera uniforme por las ediciones: algunas células mantendrán su composición genética original, mientras que otras se verán alteradas.
A medida que se desarrollan los diferentes órganos y tejidos, esta variación permanece, por lo que, si tuviera cuatro células iniciales, a una de las cuales se le dio un CCR5 mutado, podría terminar en el 25% de las células del cuerpo.
En 2018, cuando nacieron las gemelas, CCR5 era principalmente conocido por su capacidad para permitir que el virus del VIH ingresara a las células.
Hoy en día, existe un consenso emergente de que tiene una variedad de funciones, que incluyen el desarrollo del cerebro, la recuperación de accidentes cerebrovasculares, la enfermedad de Alzheimer, la propagación de ciertos cánceres y el resultado de una infección con otros patógenos.
"No sabemos cómo se verán afectadas las vidas de los bebés", dice Saha, "qué tan susceptibles serán a varios tipos de enfermedades infecciosas y qué significa esto en términos de pandemias actuales y futuras".
De hecho, se cree que las proteínas CCR5 típicas protegen contra una variedad de patógenos, como la malaria, el virus del Nilo Occidental, el virus de la encefalitis transmitida por garrapatas, la fiebre amarilla y virus respiratorios como la gripe, lo que sugiere que la edición pudo haberles robado a sus sujetos una adaptación útil.

Alternativas
Sin embargo, no todo son malas noticias. En primer lugar, no es seguro que la edición de células somáticas altere necesariamente las células reproductoras; es solo una posibilidad teórica.
Para averiguar si esto realmente está sucediendo, Saha y su equipo han estado trabajando con ratones de laboratorio, marcando las células alteradas con una proteína roja fluorescente para poder ver si al inyectar un ratón con un editor destinado, digamos, al cerebro, terminará afectando su esperma o sus óvulos.
"Hemos visto muchos glóbulos rojos en el cerebro", dice Saha. "Hasta ahora, no hemos visto nada en los órganos reproductivos, lo cual es un buen resultado tranquilizador".
En segundo lugar, no toda la edición somática tiene que ocurrir dentro del cuerpo. Para algunos trastornos, como la anemia de células falciformes, el tejido afectado -en este caso, los glóbulos rojos- se puede extraer y tratar fuera del cuerpo.
Esto significa que el editor solo encuentra las células a las que se dirige, y casi no hay riesgo de que las mutaciones se transmitan de generación en generación.
Finalmente, podría reducirse el uso de esta técnica a quienes no tengan riesgos de pasar esos cambios a una nueva generación. Por ejemplo, ofreciéndosela solo a pacientes que hayan pasado la edad fértil o que se acerquen al final de sus vidas.
Según Saha, es probable que haya muchas personas que estén dispuestas a sacrificar la posibilidad de tener hijos para mejorar su calidad de vida.
Él cree que el camino a seguir es asegurarse de que los pacientes estén bien informados de los riesgos antes de aceptar dichos procedimientos.
Un experimento intergeneracional
Pero digamos que terminamos con errores artificiales en el acervo genético humano. ¿Exactamente qué tan permanentes podrían volverse?

Según el profesor Greely, quien ha escrito un libro sobre las implicaciones del proyecto de He, la respuesta depende de qué hacen las ediciones y cómo se heredan.
"Es posible que simplemente mueran o se vean abrumados por el vasto mar de genes normales y la variación genética normal", dice.
"Algunas personas tienen el temor de que, si se hace un cambio, eventualmente todos los seres humanos llevarán ese cambio. Eso es realmente poco probable a menos que el cambio sea muy, muy beneficioso".
Esto último es, por supuesto, una posibilidad. Ya sea que una mutación se genere mediante un error de edición o errores naturales, en ocasiones las mutaciones son útiles.
Algunos expertos incluso han sugerido que a los bebés CCR5 se les puede haber mejorado el cerebro de forma inadvertida.
El argumento se deriva de una investigación que muestra que la versión natural del gen que heredan la mayoría de los humanos -el tipo que habrían tenido los bebés-, en realidad suprime la "neuroplasticidad" del cerebro o la capacidad de crecer y reorganizarse.
Algunos estudios han demostrado que las personas que carecen de un CCR5 normal pueden recuperarse de los accidentes cerebrovasculares más rápidamente y, según se informa, les va mejor en la escuela, mientras que los ratones sin una versión funcional de este gen tienen mejor memoria.
Sin embargo, hay algunas situaciones en las que las mutaciones raras pueden propagarse ampliamente, sean útiles o no.
Tomemos como ejemplo la enfermedad de Huntington, una afección desgarradora que gradualmente detiene el funcionamiento normal del cerebro y finalmente causa la muerte.
Es inusual para una enfermedad genética, porque, incluso si tienes una copia sana del gen, desarrollarás la enfermedad, lo que significa que sería esperable que eventualmente desaparezca.
Sin embargo, en el Lago de Maracaibo, en el noroeste de Venezuela, hay una mayor concentración de personas con la enfermedad que en cualquier otro lugar del mundo.
Hay dos teorías sobre por qué esto estaría pasando. Una es que la enfermedad se materializa típicamente cuando las personas tienen alrededor de 40 años, es decir, después de que la mayoría tuvo hijos, y potencialmente les pasó la enfermedad.
La segunda es el llamado Efecto Fundador, que distorsiona la distribución de genes en poblaciones pequeñas al permitir que los genes inusuales de los "fundadores" - los primeros miembros de la comunidad - se propaguen más ampliamente de lo habitual.

Se cree que los pacientes con Huntington en el Lago de Maracaibo comenzaron con una sola mujer, María Concepción Soto, quien se mudó al área desde Europa a principios del siglo XIX.
Ella era portadora de la mutación mortal que la causa, que transmitió a más de 10 generaciones de descendientes, que abarca a más de 14,761 personas vivas, a partir de 2004.
Si Nana o Lulu se mudaran a un área menos poblada, con baja migración, como una isla aislada, o se unieran a un grupo religioso con reglas estrictas sobre matrimonios mixtos, es posible que sus mutaciones establezcan una prevalencia relativamente alta en esa comunidad.
En China, donde se cree que viven, actualmente hay altas tasas de migración interna, por lo que es posible que sea menos probable que los genes se incrusten.
Posibles soluciones
Más allá de esto, Saha señala que pueden pasar muchas, muchas generaciones para que se pueda detectar cualquier patrón en la distribución de los errores genéticos.
Existe una solución obvia, aunque no hay garantía de que los humanos editados estén de acuerdo con ella: en lugar de permitir que las mutaciones artificiales se propaguen, simplemente podríamos corregirlas, utilizando la misma técnica que se utilizó para crearlas en primer lugar.
"Creo que es una posibilidad real", dice Greely. "O [si una persona tiene una copia sana, como Lulu] debería poder utilizar la selección de embriones, para asegurarse de que su descendencia no reciba la versión alterada".
Sin embargo, esta solución se basa no solo en la voluntad individual, sino también en que una persona sepa que sus células reproductivas han sido editadas, como puede no ser el caso de quienes se han sometido a una edición somática por una enfermedad que se manifiesta en otras partes del cuerpo.
Dado lo poco que sabemos sobre las funciones de ciertos genes en nuestro entorno actual, Saha cree que debemos ser más cautelosos al realizar cambios potencialmente milenarios.
"Me sorprendo todos los días por cuántas funciones diferentes tienen los genes; trato de ser lo más humilde posible en términos de asumir que sé todo lo que haría una mutación genética en una célula humana", dice.
"Estos son genes que han estado involucrados en nuestro genoma durante miles de años, si no más, por lo que saber cómo funcionarán para los humanos en diferentes contextos durante los próximos cien años es realmente un desafío".
Para decidir si una edición es ética, es posible que primero necesitemos comprender en qué tipo de mundo futuro podría permanecer.
Ahora puedes recibir notificaciones de BBC Mundo. Descarga la nueva versión de nuestra app y actívalas para no perderte nuestro mejor contenido.


